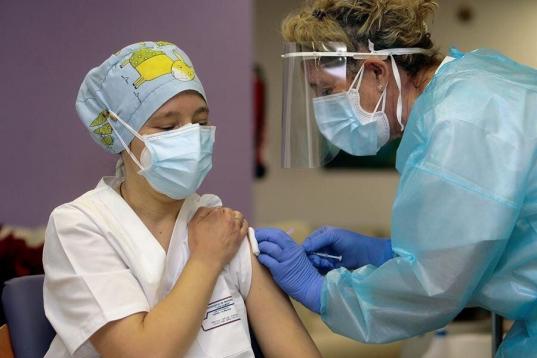
Johnson & Johnson solicita la aprobación de su vacuna contra la covid en EEUU
La farmacéutica pedirá la autorización a las autoridades sanitarias de la UE en las próximas semanas.

La compañía estadounidense Johnson & Johnson ha solicitado la autorización para el uso de emergencia de su vacuna contra el coronavirus a la Administración de Alimentos y Medicamentos de Estados Unidos (FDA, por sus siglas en inglés). La empresa ha anunciado que pedirá la aprobación de las autoridades sanitarias de la Unión Europea en las próximas semanas.
A diferencia de las otras vacunas aprobadas hasta ahora, el fármaco de Janssen solo requiere una inyección. Además, se puede almacenar en frigoríficos normales, a diferencia de las otras que necesitan congeladores ultrafríos.
Si recibe la aprobación de la FDA, esta vacuna sería la tercera autorizada por las autoridades sanitarias de Estados Unidos tras los fármacos de Pfizer y Moderna. Por su parte, la Agencia Europea de Medicamentos (EMA, por sus siglas en inglés) también ha aprobado la vacuna de AstraZeneca.
“La presentación de hoy para la autorización de uso de emergencia de nuestra vacuna de inyección única es un paso fundamental para reducir la carga de enfermedad para las personas en todo el mundo y poner fin a la pandemia”, asegura Paul Stoffels, vicepresidente del comité ejecutivo y científico jefe de Johnson & Johnson, en el comunicado.
Una eficacia del 66% a nivel global
Esta solicitud llega una semana después de conocerse el informe sobre la eficacia de la vacuna. La tercera fase del ensayo clínico mostró una eficacia del 66% en la prevención del desarrollo de síntomas moderados y severos de la covid a nivel global.
La vacuna elaborada por Janssen no es tan eficaz contra el coronavirus como las otras que se han aprobado hasta ahora. El fármaco de Pfizer / BioNTech tuvo una eficacia del 95%, el de Moderna del 94,5% y el de la Universidad de Oxford y AstraZeneca del 70,4%.
Este ensayo se realizó en tres regiones, Estados Unidos, América Latina y Sudáfrica, y contó con la participación de casi 44.000 voluntarios. La eficacia de la vacuna aumenta al 72% si solo se tienen en cuenta los casos analizados en Estados Unidos, mientras que solo llega al 57% en Sudáfrica, donde circula una variante más peligrosa del coronavirus.
Uno de los datos más esperanzadores que arroja el estudio es que fue un 85% efectiva para detener la enfermedad grave y prevenir la hospitalización en todas las geografías y contra múltiples variantes 28 días después de la inmunización.
La UE recibirá 200 millones de dosis
Una vez realizada la solicitud, los miembros de la FDA examinarán los datos proporcionados por la farmacéutica. Además, un grupo de asesores externos se reunirá el próximo 26 de febrero para estudiar la solicitud y hacer una recomendación sobre su aprobación.
Esta farmacéutica se ha comprometido a entregar 100 millones de dosis a Estados Unidos antes de junio de 2021. “Estamos trabajando con gran urgencia para que nuestra vacuna en investigación esté disponible al público lo antes posible”, afirma Stoffels en el comunicado.
Esta solicitud es una buena noticia para los países de la Unión Europea, ya que se puede acelerar la campaña de vacunación. La Comisión Europea firmó un acuerdo con empresa para recibir 200 millones de dosis, una cantidad ampliable en otros 200 millones de dosis.