¿Salió el SARS-CoV-2 de un laboratorio?
La hipótesis de que la pandemia pueda ser fruto de un accidente de laboratorio ha recobrado fuerza a pesar de no disponer de nuevas evidencias que apunten en esa dirección. Aunque lo más probable es que su origen sea zoonótico.

El pasado 14 de mayo, un grupo de científicos de universidades como Harvard, Chicago, Toronto, Cambridge, Yale, Stanford, Berkeley y otras, publicaron una carta en la revista Science en la que solicitaban seguir estudiando el origen del SARS-CoV-2:
Qué pasa, ¿qué ahora todos se han vuelto negacionistas y conspiranoicos?
- Si usted me pregunta, ¿es posible hoy en día crear un nuevo virus artificial en el laboratorio? La respuesta es sí. Mire, por ejemplo, este artículo publicado en PNAS.
- ¿Es posible que un virus se escape de un laboratorio de seguridad? La respuesta también es sí. Mire, por ejemplo, este brote de SARS, este de Brucellosis y el descubrimiento del virus de Marburgo.
- Entonces, ¿el SARS-CoV-2 se ha creado artificialmente y se ha escapado de un laboratorio? No podemos descartarlo, pero lo más probable es que no. Una cosa es que sea posible, otra distinta qué es lo más probable.
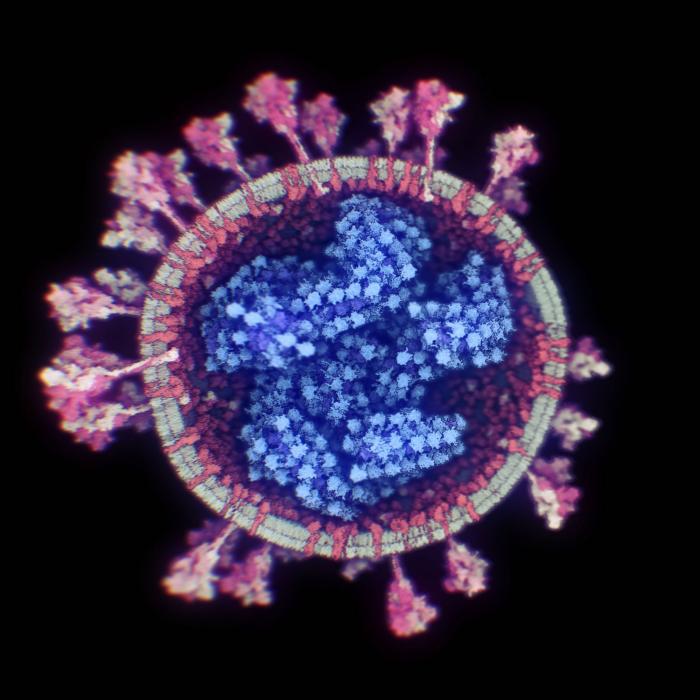
Los coronavirus (CoV) de animales se conocen desde finales de los años 30, y se clasifican en cuatro géneros (alfa, beta, gamma y delta-CoV). Los beta-CoV contiene a la mayoría de los que infectan a humanos y se subdivide a su vez en cuatro linajes (A, B, C y D). El origen de la mayoría de los alfa y beta-CoV está en los murciélagos y roedores, mientras que las aves son el mayor reservorio natural de los gamma y delta-CoV.
Desde hace miles de años, los CoV han estado constantemente cruzando la barrera entre especies. Una de las características de los coronavirus es su tremenda capacidad de saltar de una especie animal a otra.
Causan, principalmente, enfermedades respiratorias y gastrointestinales en muchos animales de granja y domésticos: el virus de la bronquitis infecciosa de las aves, el coronavirus respiratorio canino, la hepatitis murina, el coronavirus bovino, el virus de la gastroenteritis transmisible en cerdos, la peritonitis infecciosa felina y un largo etcétera. Uno de los animales que más tipos diferentes de coronavirus alberga y que, por tanto, actúa como un almacén o reservorio natural es… el murciélago.
Se han identificado más de 200 tipos distintos de CoV en los murciélagos y el 35% del viroma (el conjunto de genomas de virus) del murciélago son CoV. Por cierto, los murciélagos no son roedores, son los únicos mamíferos voladores, de los que existen más de 1 200 especies distintas, representan aproximadamente un 20% de todas las especies de mamíferos, y están presentes en todos los continentes, excepto en la Antártida. Algunas de sus colonias pueden albergar cientos de miles de individuos.
En humanos, además del SARS-CoV-2, se conocen otros seis coronavirus que causan enfermedad. Cuatro de ellos causan una infección leve y se denominan seguido de un código: HCoV-229E, HCoV-OC43, HCoV-NL63 y HCoV-HKU1. El 30% de los catarros comunes están producidos por estos cuatro coronavirus, en algunos casos también cursan con trastornos digestivos, y en niños y personas mayores inmunocomprometidas pueden llegar a ser graves. Su distribución es global y tienden a ser estacionales.
El primero que se descubrió fue el HCoV-229E, que se aisló del tracto respiratorio de un paciente en 1966. Al año siguiente, se aisló el HCoV-OC43. A finales de 2004 se descubrió el HCoV-NL63 aislado de un bebé de siete meses en Holanda, y el mismo año se aisló el HCoV-HKU1 de un paciente de 71 años hospitalizado por neumonía y bronquiolitis en Hong Kong.
En 2002, se describió el SARS-CoV (8 096 casos y 774 muertos) que causaba una neumonía aguda y severa. Se extendió por 27 países.
Diez años después, en 2012 apareció el MERS-CoV, un nuevo coronavirus que causó el síndrome respiratorio de Oriente Medio, y que, aunque infectó a menos personas, unas 2 500, su letalidad fue mucho mayor, de hasta el 35%. El MERS-CoV todavía se aísla de forma esporádica.
Todos estos HCoV tiene un origen animal. HCoV-NL63, HCoV-229E, SARS-CoV y MERS-CoV se han originado en CoV de murciélagos, mientras que el origen de HCoV-OC43 y HCoV-HKU1 está en los roedores. A este tipo de virus que infectan al ser humano pero que tienen un origen animal se les denomina zoonóticos.
En este salto desde el murciélago o el roedor al ser humano ha habido otros animales que han actuado como intermediarios, en los que los virus se han ido adaptado para infectar al ser humano: las civetas y los mapaches en el caso del SARS-CoV, los dromedarios en MERS-CoV, o el ganado vacuno en HCoV-OC43. Murciélagos y roedores actuarían, por tanto, como reservorio natural o lugar donde los ancestros de estos HCoV viven y se multiplican y son el origen común de infecciones en otros animales. En los hospedadores intermedios, los CoV se irían adaptado al ser humano.
Actualmente, los HCoV-229E, HCoV-OC43, HCoV-NL63 y HCoV-HKU1 están muy adaptados al ser humano, son fácilmente transmisibles y causan infecciones leves. Por el contrario, SARS-CoV y MERS-CoV son mucho más patógenos, no están tan bien adaptados y por eso su transmisión entre humanos no es tan frecuente (desde 2004 no se ha vuelto a detectar ningún caso de SARS-CoV, y los brotes de MERS-CoV siguen estando asociados al contacto con dromedarios que actúan como reservorio intermedio del virus).
La familia de los coronavirus es muy diversa, se mezclan entre ellos y saltan de una especie animal a otra. No podemos descartar, por tanto, que otro nuevo coronavirus como SARS-CoV y MERS-CoV vuelva a aparecer y a darnos problemas.
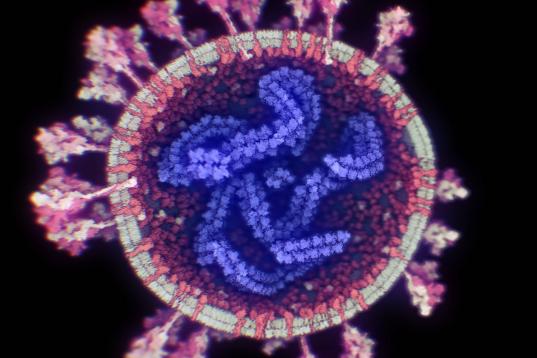
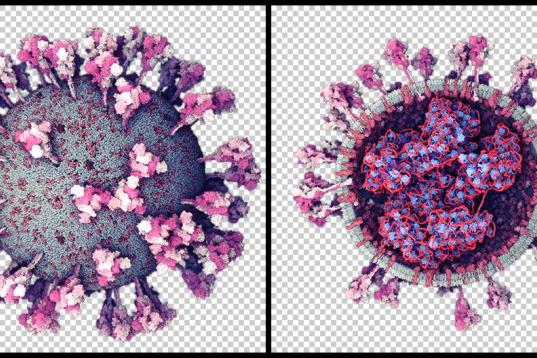
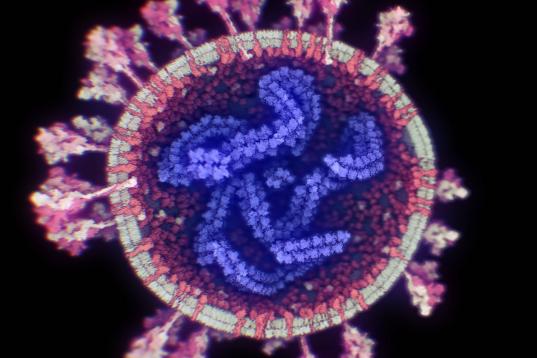
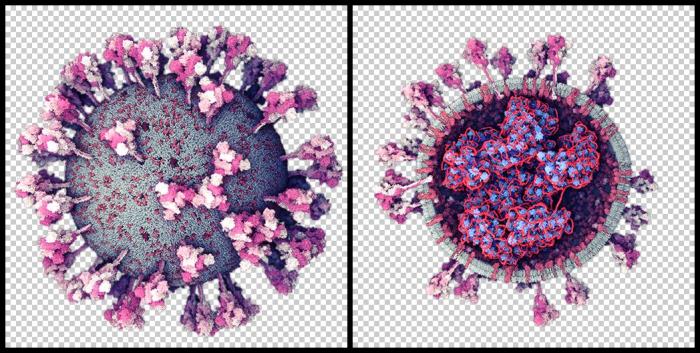
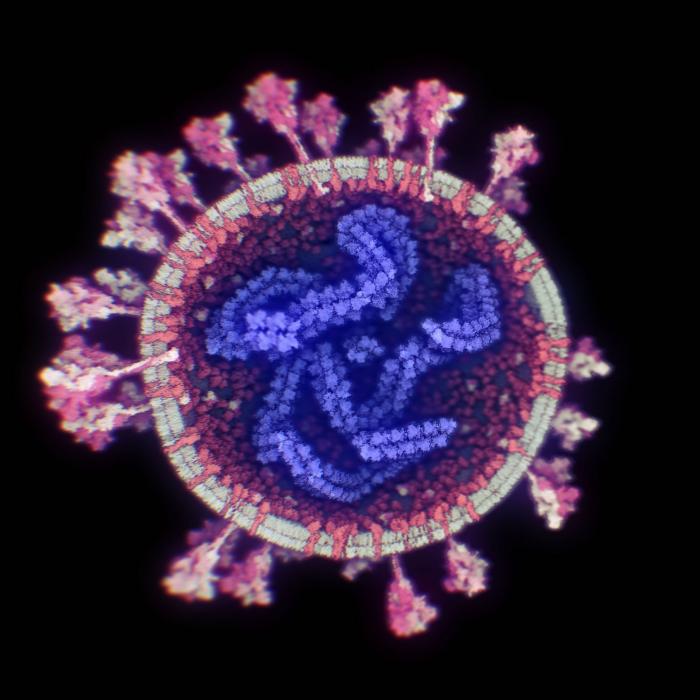
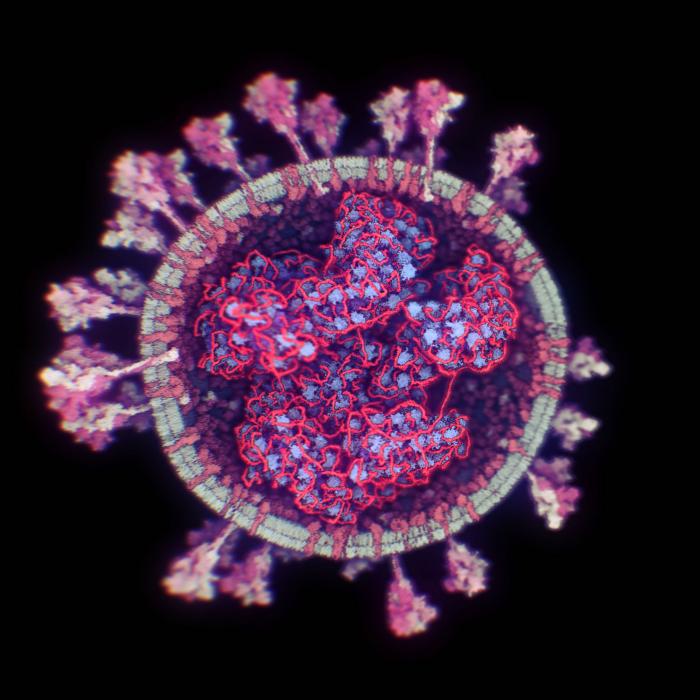
Una de las zonas del genoma más interesantes del SARS-CoV-2 para investigar su origen es la que codifica para la proteína S, porque es la más variable y porque su función es esencial para la entrada en la célula, al unirse al receptor de la membrana celular, el ACE2.
Los modelos en 3D demuestran que la proteína S se divide en dos subunidades, S1 y S2, que se separan por la acción de una enzima de la célula con actividad proteasa, la furina. Los análisis estructurales, genómicos y bioquímicos de esa proteína S nos permiten estudiar este proceso en detalle y demuestran que SARS-CoV-2 posee dos particularidades importantes, que pueden relacionarse con su origen.
- El dominio RBD de la proteína S tiene una alta afinidad por el receptor ACE2. La proteína S posee una secuencia que se denomina RBD (dominio de unión al receptor), la parte más variable del genoma del virus, en la que hay seis aminoácidos que son esenciales para unirse al receptor ACE2. Si comparamos esa secuencia entre SARS-CoV-2 y el SARS-CoV, solo un aminoácido de esos seis es común. Sin embargo, los análisis computacionales indican que ese dominio no es el mejor posible para unirse al receptor, teóricamente puede haber otras combinaciones que sean aún más eficaces para unirse al receptor. Esto sugiere que esa secuencia ha surgido por un proceso de selección natural a lo largo de pases del virus entre personas o animales. Si alguien hubiera diseñado este nuevo virus para que fuera patógeno lo hubiera hecho mejor.
- La proteína S posee una secuencia de corte por furina entre las subunidades S1 y S2 de la proteína. Aunque algunos HCoV, como el HKU1, también tienen esa característica, el sitio de corte por furina no es muy frecuente en todos los coronavirus, y menos en los del grupo beta, al que pertenece el SARS-CoV-2. Esta secuencia tan peculiar, ¿podría ser fruto de la manipulación genética del virus? Si lo comparamos con lo que ocurre en el virus de la gripe, muy probablemente se haya generado también por selección natural. En algunos virus de la gripe aviar se ha visto que en situaciones de alta densidad de poblaciones de aves, se selecciona de forma natural este tipo de secuencias de corte en la hemaglutinina de la envoltura (similar a la proteína S del coronavirus). Esto hace que el virus se replique más rápidamente y sea más transmisible. Así es cómo algunos virus de gripe aviar de baja patogenicidad se convierten en virus de alta patogenicidad. También se ha observado la adquisición de estos sitios de corte en la hemaglutinina después de pases repetidos del virus en cultivo celular o en animales. Por lo tanto, esta nueva propiedad del virus de la gripe es fruto de la selección natural, y lo mismo ha podido ocurrir en el coronavirus.
Si el origen del genoma de SARS-CoV-2 fuera la ingeniería genética, muy probablemente se habrían empleado algunos sistemas genéticos ya presentes en otros beta-CoV y los datos no demuestran nada de esto. Por el contrario, lo más probable es que estas dos características del virus sean fruto de la selección natural.
Una posibilidad es que esas características se hayan seleccionado en un animal antes de transferirse al ser humano. Cuando se comparan los genomas de los CoV, el más parecido al SARS-CoV-2 es el aislado de un murciélago en Yunnan (China) en 2013, el genoma RaTG13 de Rhinolophus affinis, con más de un 96% de identidad.
Sin embargo, cuando se compara la zona RBD de la proteína S difieren significativamente. Aunque el virus del murciélago sigue teniendo una homología a nivel del genoma mayor, la similitud entre el SARS-CoV-2 y los coronavirus del pangolín es especialmente alta en ese dominio RBD de la proteína S. Esto refuerza la idea de que la optimización de la proteína S para unirse al receptor ACE2 humano es fruto de la selección natural y no de ingeniería genética o de pases sucesivos del virus en un laboratorio.
Sin embargo, ni los coronavirus de murciélagos ni los de los pangolines tienen el sitio de corte de furina en la proteína S. Los coronavirus son muy frecuentes entre estos y otros animales y es muy probable que todavía no hayamos dado con el precursor animal del SARS-CoV-2. No podemos descartar que fenómenos de mutación, inserción y deleción hayan ocurrido de forma natural en el gen S en algún otro animal, probablemente con alta densidad de población y con un receptor ACE2 similar al humano.
Otra posibilidad que no se puede descartar es que el SARS-CoV-2 haya adquirido esas características mientras se transmitía de forma indetectable entre humanos. Todos los genomas de SARS-CoV-2 secuenciados hasta ahora demuestran que tienen un origen clonal a partir de un ancestro común en Wuhan, muy probablemente a principios de noviembre de 2019. La presencia en los pangolines del mismo dominio RBD en la proteína S sugiere que esa característica ya estaba en el virus antes de su salto a humanos. Quizá, entonces, el sitio de corte por furina fue el que se seleccionó durante la transmisión entre humanos.
Esto presupone que el virus estaba presente antes de noviembre de 2019 y que se transmitía entre nosotros de forma indetectable durante un tiempo. Eso ahora no lo sabemos, pero sería muy interesante si somos capaces de hacer estudios retrospectivos y comprobar si realmente el virus circulaba entre humanos antes de su estallido en Wuhan a finales de 2019.
Como vemos, las peculiares características de SARS-CoV-2 ya estaban en la naturaleza y no hay que imaginar experimentos de laboratorio para explicar su origen. Conocemos menos del 1% de los virus que hay ahí fuera y más del 70% de los nuevos virus emergentes tienen su origen en los animales.
Los virus son millones de millones de partículas, que se multiplican a una velocidad enorme y con una frecuencia de mutación y recombinación extraordinaria. Los virus no es que muten, es que viven mutando. En ellos, la evolución va a cámara rápida.
Otro dato interesante es que hay una gran cantidad de animales que son susceptibles a una infección experimental con SARS-CoV-2: gatos, perros, hurones, visones, hámster, algunas especies de ratas y ratones, macacos, mono verde africano, musarañas, murciélagos frugívoros, mapaches, conejos de laboratorio, ganado bovino… Por otra parte, se han demostrado infecciones adquiridas naturalmente de SARS-CoV-2 en perros, gatos y hurones en entornos domésticos, en tigres, leones, pumas y leopardos en colecciones zoológicas, en gorilas y en granjas de visón americano. De momento, las granjas de visones son la única evidencia de mantenimiento de una infección adquirida naturalmente en una población animal y salto a los humanos.

A pesar de todo lo que acabamos de decir, es verdad que hay dudas razonables sobre qué se hacía y cómo se trabajaba en el Instituto de Virología de Wuhan.
China tardó ¡un año! en permitir que un equipo internacional de la OMS visitara Wuhan para investigar sobre el origen del virus. Su conclusión fue que “muy probable” el SARS-CoV-2 tuviera un origen animal, aunque no se sabe cuál. Desgraciadamente, fue el Gobierno chino el que recogió los datos y las muestras y recopiló toda la información, mientras que el equipo internacional solo pudo trabajar sobre esos datos e informes.
Por otra parte, se sabía que desde antes de 2008, se venían realizando experimentos de manipulaciones genéticas de los coronavirus SARS y MERS, denominadas “ganancias de función”, para mejorar su capacidad de infección y transmisión. Y desde 2014, el Gobierno estadounidense había establecido una moratoria a la financiación de este tipo de experimentos por su peligrosidad y un potencial pandémico.
En marzo de 2020, los máximos responsables del Instituto señalaron que ningún trabajador del mismo había dado positivo en los test de detección del SARS-CoV-2. Pero recientemente se ha hecho público que al menos tres científicos del Instituto enfermaron con síntomas compatibles de COVID-19 un mes antes del anuncio oficial de la existencia de un nuevo coronavirus, por lo que sigue habiendo serias dudas sobre el nivel de bioseguridad del Instituto.
En un informe de 2018 de técnicos del Departamento de Estado de EE.UU. para verificar la bioseguridad de las instalaciones del Instituto se mostraba la preocupación por la falta de seguridad, debilidades de gestión del laboratorio y falta de personal especializado, y describía que muchos de los trabajos no se hacían dentro de las instalaciones de BSL4.
Conclusión: con los datos que tenemos en este momento, la hipótesis más probable es que el SARS-CoV-2, como el resto de CoV humanos, sea de origen natural, a partir de un reservorio natural de CoV de murciélagos y a través de alguna especie intermedia (todavía sin identificar) donde se fue adaptando al ser humano. La naturaleza tiene suficiente recursos para generar este y cualquier otro virus.
Sin embargo, la tremenda opacidad y falta de transparencia del Gobierno chino hace que no se pueda descartar como hipótesis, menos probable pero posible, un origen en el laboratorio. Solo una investigación transparente, objetiva, basada en datos e independiente nos dirá la verdad.