La revolución científica contra las enfermedades genéticas que nace en unas salinas de Alicante
Una herramienta fascinante cuyo mecanismo de origen se descubrió en España y que ya se puede aplicar en algunos casos determinados.
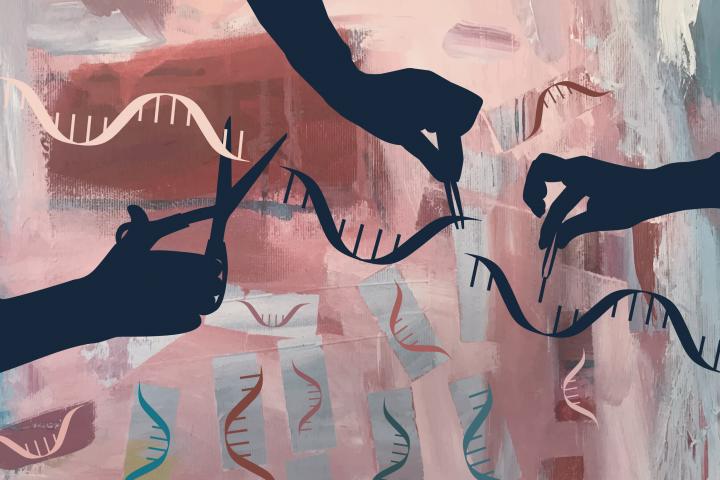
Imagina que tienes un libro gigante que contiene todas las instrucciones que hacen que seas quien eres y que tú eres el encargado de editarlo. Eso es básicamente lo que hace CRISPR, una herramienta que te permite cortar y pegar partes específicas del libro de tu ADN para hacer cambios precisos en tu genoma.
Una revolución científica que amplía el conocimiento sobre cómo funcionan los genes, que está cambiando el tratamiento de las enfermedades genéticas -ya se aplica en algunos casos- y cuyo mecanismo de origen se descubrió en España, en unas salinas de Alicante. Sin embargo, CRISPR también plantea debates éticos sobre su uso en humanos y en organismos modificados genéticamente.
De ello han hablado Ana Fuentes y Nuño Dominguez en el podcast Hoy en El País, donde han analizado los usos de esta revolucionaria técnica científica, los problemas éticos que plantea su aplicación en embriones con fines de implantación. Para ello han entrevistado a la bióloga catalana Anna Veiga, "madre científica"de la primera niña concebida por fecundación in vitro en España.
CRISPR es un acrónimo de Clustered Regularly Interspaced Short Palindromic Repeats, que en español se traduce como Repeticiones Palindrómicas Cortas Agrupadas y Regularmente Interespaciadas. Este nombre hace referencia a una secuencia de ADN que se repite en algunas bacterias y que sirven como una especie de sistema inmunológico que les permite defenderse de virus y otros organismos invasores.
¿En qué consiste CRISPR? Básicamente, la técnica utiliza esta secuencia para diseñar moléculas de ARN que guían una enzima llamada 'Cas9' para cortar y modificar el ADN en lugares específicos, lo que permite a los investigadores editar genes con precisión.
En el podcast se hace referencia al caso de Victoria Gray, una estadounidense diagnosticada de anemia falciforme, una de las enfermedades genéticas más comunes, a la que se le ha aplicado la técnica CRISPR y, después de curarse, se ha olvidado de los dolores, las transfusiones y los ingresos hospitalarios.
Esta revolución científica que se puede aplicar en el campo de la salud y que nos permite editar nuestro ADN nace en la década de 1980 en las Salinas de Santa Pola, un espacio natural protegido situado en el término municipal alicantino del mismo nombre. Allí, un joven Francis Mojica notó que algunas bacterias tenían unas extrañas repeticiones de ADN que se repetían regularmente. Años después, en 2005, publicó un artículo en el que propuso que estas secuencias podrían estar relacionadas con un sistema de inmunidad.
A partir de este descubrimiento, los científicos comenzaron a explorar la posibilidad de utilizar este sistema de defensa bacteriana para editar el ADN en otros organismos, lo que finalmente condujo al desarrollo de la técnica de edición genética CRISPR. Desde entonces, la técnica se ha convertido en una herramienta de investigación importante en biología molecular y genética, y se están explorando sus posibles aplicaciones en el tratamiento de enfermedades genéticas.
La técnica, al encontrarse en fase experimental, no tiene un precio establecido. Eso sí, es muy cara y poco accesible para la mayoría de los mortales. "Las farmacéuticas que lo están desarrollando aún no le han puesto precio, pero probablemente esté entre los dos o tres millones de dólares", apunta Nuño Dominguez antes de aclarar que con el sistema de desarrollo de fármacos habitual es poco probable que la industria se vuelque en su mejora.
Problemas éticos de CRISPR
La técnica de edición genética CRISPR plantea importantes problemas éticos, ya que su uso puede tener consecuencias a largo plazo tanto para los organismos editados como para las futuras generaciones.
La edición de ADN implica la edición de células reproductivas, lo que significa que las modificaciones genéticas se transmitirán a las futuras generaciones. Esto plantea cuestiones éticas sobre la seguridad y la responsabilidad de hacer cambios permanentes en la línea germinal. Podría, además, tener efectos secundarios imprevistos o no deseados en el medio ambiente.

















