Científicos españoles reconstruyen proteínas de hace 2.600 millones de años capaces de editar los genes
Los investigadores las están utilizando para corregir el albinismo en células humanas.
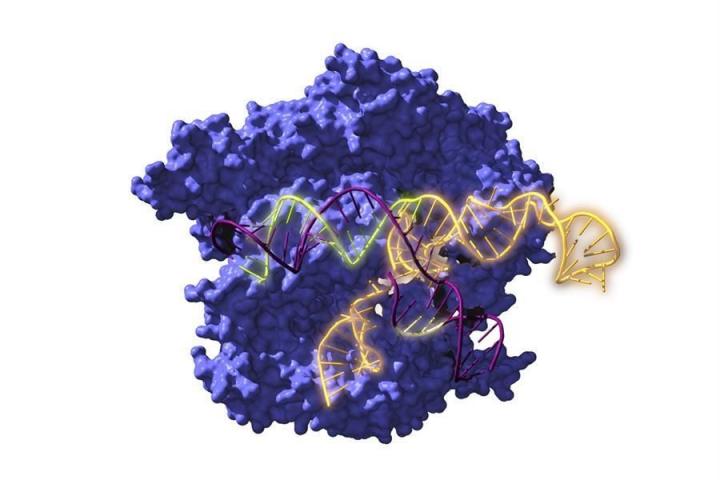
Un viaje en el tiempo de hace nada menos que 2.600 millones de años para abrir 2023. Sobre estas bases, un equipo de investigadores españoles ha logrado acceder a proteínas ancestrales con la misma capacidad de editar los genes que los sistemas actuales e incluso con mayor variedad.
El hallazgo ha sido publicado este lunes en la revista Nature Microbiology y se sustentan en unas proteínas “resucitadas” del sistema CRISPR/Cas. Los datos abren nuevas vías para las llamadas tijeras de edición genética que podrían tener aplicaciones revolucionarias.
De momento, ya están trabajando para corregir el albinismo en células humanas como han adelantado los investigadores de diferentes centros españoles, aunque podrían ampliarse su uso.
Como informa el Centro Superior de Investigaciones Científicas, participante del trabajo, el acrónimo CRISPR es el nombre de unas secuencias repetitivas presentes en el ADN de muchas bacterias que albergan fragmentos de material genético de virus que han infectado a sus antepasados. Esto le permiten reconocer si se repite la infección y defenderse cortando el ADN de los invasores mediante proteínas Cas asociadas a estas repeticiones.
La ciencia ha desarrollado este sistema para servirse, desde hace años, como una herramienta de edición que permite modificar el genoma con una precisión sin precedentes, de forma sencilla y más barata, lo que abre grandes posibilidades para tratar enfermedades congénitas.
La gran mayoría de laboratorios usan el CRISPR-Cas9, que procede de Streptococcus pyogenes, una bacteria patógena que provoca otitis y laringitis, por lo que muchas personas tienen anticuerpos. En esos casos no se podría usar como terapia génica porque el sistema inmunitario lo atacaría.
“Son necesarios más sistemas CRISPR-Cas”, explica a EFE el genetista Lluís Montoliu, vicedirector del Centro Nacional de Biotecnología (CNB) del Consejo Superior de Investigaciones Científicas (CSIC), uno de los firmantes de la investigación que comenzó en 2018. Para ello, la ciencia ha ido a identificar en los “sitios más recónditos”, desde el desierto de Atacama a Groenlandia, nuevas bacterias que no tengan relación con nosotros a partir de las cuales aislar nuevos sistemas CRISPR, “lo que -dice- ya está dando sus frutos”.
Sin embargo, el equipo coordinado por Raúl Pérez-Jiménez de la Asociación-Centro de Investigación, Cooperativa en Nanociencias (CIC nanoGUNE) del País Vasco lo que hizo fue viajar en el tiempo. “Nos hemos ido a intentar resucitar proteínas CAS que llamamos ancestrales y que debieron de existir en bacterias que vivieron hace miles de millones de años”, explica Montoliu.
Un viaje al pasado con cinco momentos clave
Los investigadores han reconstruido, por primera vez, la historia evolutiva de los sistemas CRISPR-Cas, desde ancestros de hace 2.600 millones de años hasta la actualidad con el uso de técnicas bioinformáticas. Para ello, seleccionaron un grupo de bacterias más o menos relacionadas evolutivamente de las que se escogió la secuencia del gen Cas9 para introducirla en un ordenador, que calculó hacia atrás cuál podría ser la secuencia de bacterias ancestrales que dio lugar a la variabilidad actual.
Montoliu precisa que no se sabe qué bacterias vivieron en la época de los dinosaurios o mucho más atrás, hasta 2.600 millones de años, pero sí que la secuencia de aminoácidos creada por el ordenador es compatible con las que tenemos hoy en día.
En toda esa línea temporal, el equipo escogió cinco momentos: hace 37 millones de años; 137 millones; 200 millones, 1.000 millones y 2.600 millones para seleccionar las secuencias de aminoácidos a partir de las cuales se sintetizó en un laboratorio la correspondiente molécula de ADN para estudiar y confirmar su funcionalidad.
Esta fue la labor del laboratorio de Montoliu, introducir estas secuencias de CRISPR ancestrales en células humanas en cultivo y comprobar que podían editar el gen que querían como si estuvieran usando un sistema Cas-9 actual.
“Sorprendentemente siguen funcionando como herramientas de edición genética. Las usamos sobre dos genes que cuando están mutados causan albinismo y comprobamos que funcionan”. Ya validado el sistema en células humanas, el siguiente paso sería hacerlo en un modelo animal, como un ratón, y luego verificar su seguridad y eficacia para poder plantear su uso en ensayos clínicos y terapias, apunta Montoliu.
La investigación también ha revelado que el sistema CRISPR-Cas se ha ido haciendo más complejo a lo largo del tiempo y se ha ido adaptando a las nuevas amenazas de virus que las bacterias han sufrido en su evolución.
“Un sistema que se ha ido puliendo a lo largo de miles de millones de años, desde una maquinaria rudimentaria, poco selectiva en sus inicios, hasta convertirla en un sofisticado mecanismo de defensa capaz de distinguir con gran precisión el material genético de invasores indeseados que debe destruir, de su propio ADN”. Así lo explica, citado por el CSIC, el investigador de la Universidad de Alicante y también firmante del estudio Francis Mojica, que fue el descubridor del sistema CRISPR.
Los actuales sistemas CRISPR están adaptados para funcionar dentro de una bacteria, pero cuando se usan en células humanas el sistema inmune provoca un rechazo y existen además determinadas restricciones moleculares que limitan su uso. Sin embargo, destaca Pérez-Jiménez que “en los sistemas ancestrales algunas de esas restricciones desaparecen, lo que les confiere una mayor versatilidad”.
Este logro proporciona herramientas de edición genética con propiedades distintas a las actuales, “mucho más flexibles, lo cual abre nuevas vías en la manipulación del ADN y el tratamiento de enfermedades”, agrega en la nota del CSIC la investigadora del proyecto nanoGune Ylenia Jabalera.









