Siete avances contra el cáncer que invitan a la esperanza
La investigación no frena y cada vez son más los descubrimientos que alargan la tasa de supervivencia de los pacientes.
La pandemia del coronavirus que se vive en todo el mundo desde hace casi dos años ha hecho que otra pandemia pasase a un segundo plano. Los diagnósticos de cáncer cayeron un 20% durante la primera ola de la covid-19, según datos de la Sociedad Española de Oncología Médica (SEOM).
Además, según ha apuntado Ramón García Sanz presidente de la Sociedad Española de Hematología y Hemoterapia (SEHH) en el evento El cáncer no espera, tú tampoco deberías en este periodo de tiempo —entre marzo y junio de 2020— “en España, una de cada cinco personas sufría la enfermedad sin saber que tenía cáncer”.
A pesar de esto, el mensaje que se da desde la investigación invita a la esperanza. “Mi mensaje es optimista; el cáncer se está transformando en una dolencia curable o crónica, cada vez hay más oportunidades de mejora en todos los ámbitos. Hay que buscar cómo superar este paréntesis y volver a la senda de supervivencia”, señala García Sanz.
Lo cierto es que en los últimos años y, en especial, en este 2021, ha habido buenas noticias en el plano de la investigación, el diagnóstico y los tratamientos que invitan a cierto optimismo contra el cáncer. Estas son algunas de ellas.
El pasado 27 de enero se hizo público que científicos del Instituto Hospital del Mar de Investigaciones Médicas (IMIM) y del Instituto de Investigación de Biomedicina de Barcelona (IIBB-CSIC-Idibaps) descubrieron unos nuevos marcadores tumorales para el cáncer de páncreas, que es uno de los más mortales, siendo la tercera causa de fallecimiento por cáncer en el mundo.
Según explicó a EFE la investigadora del IMIM Neus Martínez-Bosch, han comprobado la utilidad del receptor tirosina-quinasa AXL, una proteína presente en la superficie de las células, para detectar en los pacientes la presencia de cáncer de páncreas.
Esta proteína está habitualmente ausente en células normales, pero está demostrado que su presencia se incrementa de forma notable en determinados tipos de tumores, como los de páncreas, en los que está relacionada con la progresión de la enfermedad.
La falta de marcadores de diagnóstico ante este tumor era uno de los problemas que se encontraban en su tratamiento, ya que se llegaba tarde y solo un 20% de ellos eran operables y es habitual la metástasis y la resistencia al tratamiento en los tumores más avanzados.
La médica adjunta del Servicio de Oncología del Hospital del Mar, Laura Visa, resaltó a EFE que “disponer de una nueva herramienta en el campo del diagnóstico es de especial relevancia porque el diagnóstico precoz es esencial para la cirugía del tumor, la única opción de tratamiento curativo”.
Los investigadores destacaron que esta proteína puede determinarse solo con un análisis de sangre. A partir de ahora tendrían que ver qué porcentaje de pacientes con cáncer de páncreas la tienen, ya que solo una pequeña proporción de ellos no la presentan.
Otro paso esta vez de cara a enfocar los tratamientos contra los tumores en órganos sólidos lo ha dado la Clínica Universidad de Navarra, que ha pasado a estudiar más de 500 genes para el manejo de los distintos cánceres.
El doctor Ignacio Gil-Bazo, codirector del Departamento de Oncología Médica y coordinador científico de la Línea Estratégica de Oncología de la Estrategia 2025 de la Universidad de Navarra, cuenta a El HuffPost que esto no es solo un “salto cuantitativo, sino también un salto cualitativo tanto en el diagnóstico como en el tratamiento”.
“Para comprender cómo funciona hay que entender la naturaleza de la aparición del cáncer en líneas generales. Los tumores aparecen por una mutación de los genes o que han sufrido una trastocación o un cambio de posición dentro del genoma”, explica.
“Sobre el ADN que tenemos todos en las células sanas del cuerpo, van produciéndose mutaciones al exponernos al distintos tóxicos. Ese es un ADN somático que fabrica proteínas distintas, eso hace que las células sobrevivan más de lo razonable, que no se comporten como células sanas”, añade.
Gil-Bazo recuerda que hasta ahora, en términos generales, el tratamiento del cáncer no se centraba en qué ha originado esa mutación, sino más bien al tipo de tumor (la glándula u órgano donde se producía). “Sin saber muy bien mucho más que se ha originado en esa glándula (el ovario, la próstata, la mama, el páncreas, etc.) vamos a dar un tratamiento de quimioterapia que ataca a todas las células de crecimiento rápido, por eso también se ven afectadas las mucosas, la médula ósea o el pelo”, detalla.
“En los últimos años se ha centrado la investigación en los genes que propician la aparición de los tumores y cuáles son los que mutan. No solo la aparición, también el mantenimiento, conocidos como genes directores (dirigen la enfermedad) que ordenan lo que hay que hacer en cada momento o cómo hay que sobrevivir frente a los tratamientos, etc.”, explica.
Con este estudio genético, tal y como señala Gil-Bazo, se puede ver “qué oncogenes dirigen cada tumor en cada paciente”. “Las implicaciones terapéuticas de cada gen son como si tuviéramos dos enfermedades biológicamente distintas”, añade. “Esto nos permite conocer cuáles son sus fortalezas, debilidades, cómo se va a comportar el tumor, etc. Antes de empezar el tratamiento con el paciente, puedo empezar una estrategia mucho más eficaz que evite someter al paciente a tratamientos tóxicos futiles y que van a deteriorarle y generar toxicidad”, sentencia.
El especialista apunta que esa revisión genética se solía hacer con el cáncer de pulmón o de mama, pero “se miraban 2, 3 o 4 genes, que se conocen”.
“A nivel de tratamientos, al encontrar más genes, se pueden tratar con otros medicamentos. Esto sirve para seleccionar fármacos aprobados, editados y reembolsados por la sanidad pública”, señala, pero añade a estos los de “uso expandido, de uso precoz o de programas de uso compasivo”.
“Son fármacos que están en desarrollo, con resultados preliminares muy buenos, que están aprobados en otro país, pero no aquí o que no tienen el reembolso de la sanidad pública, a la que se tarda un año”, detalla. A esto suma la cantidad de ensayos clínicos presentes, que “luchan contra casi todas esas mutaciones”.
Para Isabel Echavarría, secretaria científica de SEOM y oncóloga médico del Hospital general Universitario Gregorio Marañón de Madrid, estos medicamentos conocidos como “fármacos dirigidos” son cada vez más comunes. “Muchos de ellos orales, y en general con un perfil de toxicidad más favorable, se han convertido en el estándar de tratamiento en ciertos subtipos tumorales”, explica a El HuffPost.
También ha habido buenas noticias de cara a tratar el cáncer de próstata, uno de los más frecuentes en los varones de edad avanzada. Según la Asociación Española Contra el Cáncer (AECC), en España se diagnostican más de 1.200.000 casos nuevos cada año y es el tercero en mortalidad en varones.
Esta investigación, dirigida por Shuang Zhao, profesor de oncología en la Facultad de Medicina y Salud Pública de la Universidad de Wisconsin (EEUU), que se hizo pública en septiembre de 2021 permite clarificar dos tipos de tumores metastático de próstata, que se han denominado como luminal y basal. Esta terminación ya se utilizaba para el cáncer de mama, con el que comparte similitudes.
Gracias al tratamiento que recibieron los pacientes se comprobó mediante un experimento que los fármacos hormonales funcionaban mejor en los tumores luminales que en los basales.
Hace apenas unos días saltaba la noticia de que dos pacientes con leucemia se habían curado con sus propios leucocitos 10 años después. Todo ello gracias a una inmunoterapia llamada CAR-T, coordinada por Carl June, inmunólogo de la Universidad de Pensilvania (Estados Unidos)
Según señaló a la revista Nature, 10 pacientes han remitido la enfermedad 10 años después de iniciar este tratamiento, consistente en extraer sangre a los pacientes, seleccionar linfocitos T —glóbulos blancos que defienden al organismo ante infecciones y otros ataques— y rediseñarlos en el laboratorio con ingeniería genética para que acabasen con las células tumorales.
Un ensayo similar y con resultados igual de prometedores tuvo lugar en el Hospital Clínic de Barcelona, donde 18 de 30 pacientes con mieloma múltiple tratados desde hace año y medio dentro del programa ARI-0002h han remitido su enfermedad. Todos ellos eran resistentes a tratamientos anteriores, incluyendo un transplante de médula ósea.
Esta terapia sigue el mismo sistema que la que se dio en Pensilvania, extraer los linfocitos T, tratarlos en el laboratorio y volver a inyectarlos por vía intravenosa al paciente para que reconozcan las células cancerosas. Actualmente hay dos terapias comerciales CAR-T contra el mieloma múltiple, elaboradas por las farmacéuticas Bristol Myers Squibb y Janssen. Sin embargo, el coste ronda los 300.000 euros por paciente.
Para Echavarría, la inmunoterapia —terapia que estimula las propias defensas del paciente contra el cáncer— ha sido “la gran revolución” de los últimos años. “Es un tratamiento estándar y rutinario en multitud de tumores (melanoma, cáncer de pulmón, tumores genitourinarios…), y consigue en una proporción de pacientes largas respuestas y supervivencia”, detalla.
“Están logrando unos resultados que hace unos años no hubiéramos podido plantearnos, tanto en cánceres avanzados, en los que en ciertos pacientes logran respuestas duraderas, incluso tras la suspensión del fármaco, como en tumores localizados, aumentando las probabilidades de curación”, añade.
Una investigación financiada por la Fundación CRIS contra el cáncer también ha encontrado otra vía con la que poner freno al mieloma múltiple. Se trata de una relación con la hepatitis C, ya que en algunos de los casos, este cáncer sanguíneo está vinculado la enfermedad.
“Hemos comprobado que el 5% de los pacientes con mieloma múltiple suelen tener hepatitis C. El 50% de estos enfermos con mieloma y hepatitis C, si tratamos la hepatitis, el mieloma múltiple se retrasa en su progresión e incluso en un caso hemos comprobado la remisión completa de la enfermedad”, señala el doctor Joaquín Martínez, jefe de Hematología del Hospital 12 de Octubre y director de Unidad CRIS de Tumores Hematológicos, en una nota de prensa.
Tal y como detallan, se trata de un importante avance “ya que el mieloma múltiple se considera incurable a día de hoy”. “Este trabajo nos ha llevado más de cinco años, ha habido involucradas al menos 10 personas e incluso ha colaborado un grupo francés”, añade Martínez en el comunicado.
La vacuna del VPH (Virus del Papiloma Humano), que se aplica en el calendario vacunal de la sanidad pública en España en las niñas a los 12 años o en personas no vacunadas hasta los 18 años, es efectiva al 87% para reducir el cáncer de cuello de útero.
Según los datos desprendidos de una investigación realizada por científicos del Kings College publicada en The Lancet, las jóvenes vacunadas entre los 12 y 13 años habían reducido el cáncer de cuello de útero en un 87%, mientras que las vacunadas entre los 14 y 16 años fue de un 62%, y para las vacunadas entre los 16 y los 18 años, del 34%.
Además, en las conclusiones del estudio se señala que el programa de inmunización ante el VPH “ha eliminado casi al 100% el cáncer de cuello uterino en mujeres nacidas a partir del 1 de septiembre de 1995 en Reino Unido”.
A pesar de que la pandemia ha dejado datos de infradiagnóstico de cáncer, que repercutirán en un futuro en la supervivencia y mortalidad de la enfermedad, lo cierto es que en los últimos años se ha incrementado notablemente la cifra de pacientes que sobreviven. Basta con mirar las gráficas de la SEOM en su inform Las cifras del cáncer en España 2022.
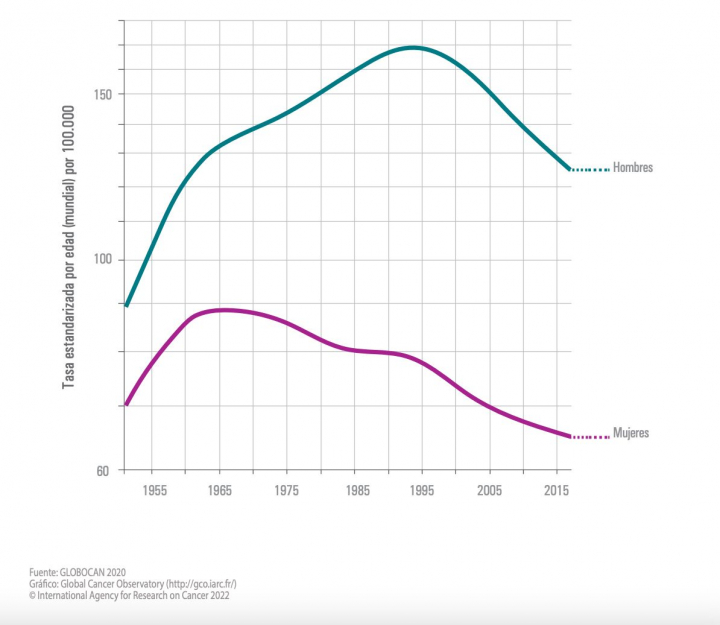
“La mortalidad en cifras absolutas muestra un leve incremento, en relación con el incremento progresivo en la incidencia del cáncer por el envejecimiento de la población”, explica Echavarría, quien apunta a que los datos de la OMS estiman que en 2040 se producirán más de 160.000 muertes por cáncer, frente a las cerca de 113.000 ocurridas en 2020.
“Sin embargo, la supervivencia de los pacientes con cáncer se ha duplicado en los últimos 40 años, y gracias a las mejoras en los tratamientos, continuará mejorando”, explica.
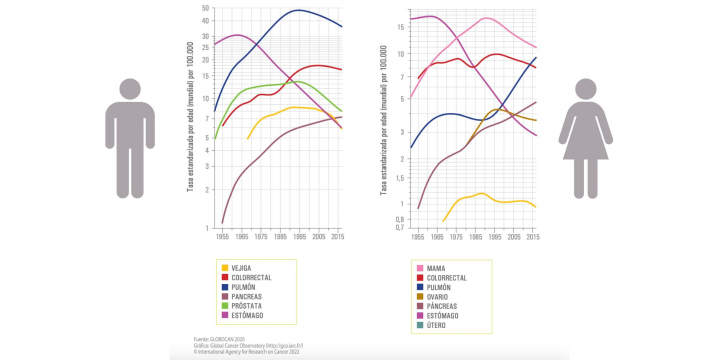
A pesar de esto, el cáncer de páncreas ha aumentado su mortalidad desde 1955, según los datos del Global Cancer Obserbatory recogidos por la SEOM, además del cáncer de pulmón en las mujeres, por el aumento del tabaquismo en los 70.
Para Echavarría, la pandemia de la covid-19 y los retrasos en el diagnóstico tendrán efecto en una subida de la mortalidad en los próximos años. “Es cierto que en ciertos casos se han producido retrasos diagnósticos y se han diagnosticado tumores en estadios más avanzados, especialmente durante la primera ola. Esto tendrá probablemente un impacto en la mortalidad por cáncer en los próximos años, aunque aún no disponemos de datos al respecto”, recalca.